Soluții
1. Dizolvarea
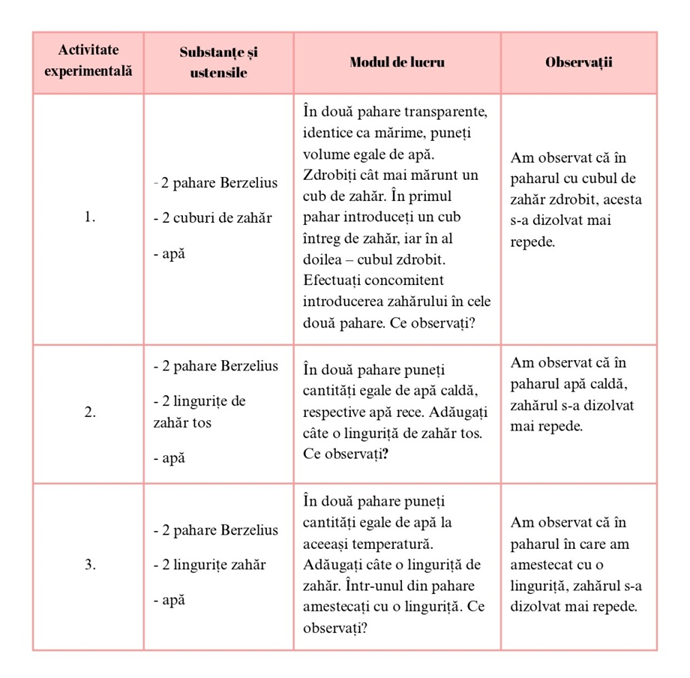
Amestecurile omogene formate din două sau mai multe substanțe între care nu se produc fenomene chimice se numesc soluții.
Fenomenul în urma căruia o substanță solidă, lichidă sau gazoasă se răspândește printre particulele altei substanțe, formând soluții se numește dizolvare.
Orice soluție este formată din doi componenți: dizolvantul (substanța în care se face dizolvarea – solvent) dizolvatul (substanța dizolvată – solvat) Într-o serie de soluții, cel mai utilizat dizolvant este apa.
În soluțiile formate din două lichide, se consideră dizolvant substanța aflată în cantitatea cea mai mare.
Factorii care influențează dizolvarea sunt: gradul de fărâmițare al substanței dizolvate (experimentul I) agitarea componenților soluției (experimentul III) temperatura (experimentul II)
2. Solubilitatea
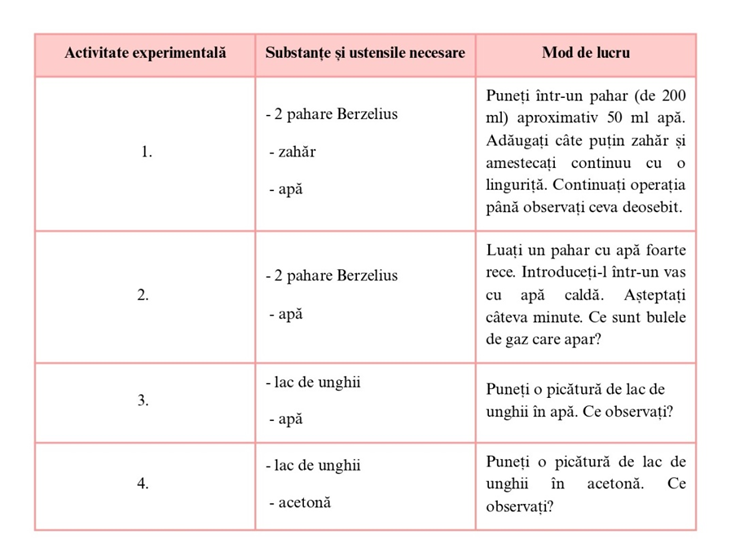
Proprietatea unei substanțe de a se dizolva în altă substanță se numește solubilitate.
După solubilitatea într-un anumit solvent substanțele se pot clasifica în următoarele categorii: substanțe solubile substanțe greu solubile substanțe insolubile
Factorii care influențează solubilitatea substanțelor sunt: natura dizolvantului și a dizolvatului și temperatura.
În general, solubilitatea substanțelor solide și lichide crește cu temperatura.
Solubilitatea substanțelor gazoase scade cu creșterea temperaturii.
Solubilitatea unei substanțe se calculează cu relația:
S=md/mapă×100
unde md – cantitatea de substanță dizolvată
mapă – cantitatea de apă
S – solubilitatea substanței
3. Concentrația soluțiilor
Cantitatea de substanță dizolvată într-o anumită cantitate de soluție se numește concentrație.
După concentrație soluțiile se pot clasifica în: soluții diluate (conțin o cantitate mică de substanță dizolvată) soluții concentrate ( conțin o cantitate mare de substanță dizolvată)
Soluțiile se pot concentra prin:
- îndepărtarea unei părți din solvent
- adăugarea unor cantități de substanță dizolvată
- adăugarea unor cantități de soluții (de același tip) mai concentrate.
Soluțiile se pot dilua prin:
- adăugarea unei cantități de solvent
- adăugarea unor cantități de soluție (de același tip) mai diluată
4. Soluții saturate și nesaturate
Soluția care conține cantitatea maximă de substanță dizolvată, la o anumită temperatură, se numește soluție saturată.
Soluția care mai poate dizolva noi cantități de substanță, până la saturație, se numește soluție nesaturată.
Concentrația procentuală este cantitatea de substanță dizolvată în 100 g soluție se numește concentrație procentuală.
Se calculeayă cu relaţia matematică:
c% = md/ms ×100
Se notează cu: md – masa dizolvatului
ms – masa soluției
mH2O – masa apei
c – concentrația soluției
md, ms, mH2O trebuie să fie exprimate în aceeași unitate de măsură (g, kg)
ms = md + mH2O